B. 伝染力が強く動物を致死させる恐れがある微生物
Ectromelia virus (またはMouse poxvirus: エクトロメリアウイルス )
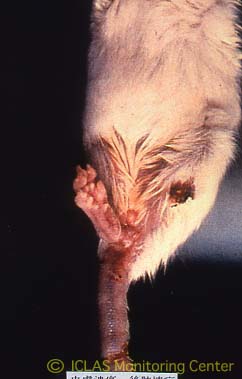
エクトロメリアウイルスはポックスウイルス科に属するDNAウイルスである。オルソポックス属にはワクシニアウイルスおよび本ウイルス、サルポックス、ウサギポックスなど実験動物のポックスウイルスが存在し、属間で抗原性が交差する。エクトロメリアの名前は、四肢、耳、尾などに壊死、脱落が起こり、外見上奇形のような状態を呈することから「奇肢症」の意味である。
自然宿主はマウスのみである。伝播力は強く、汚染マウスコロニーにおける生存マウスの抗体陽性率は100%に達し、死亡率が80%を超えることもある。全系統が感受性であるが、特にA、CBA、C3H、BALB/cなどの近交系は感受性が高く、C57BL/6はそれらに比べると抵抗性で、ときには不顕性感染を呈する。不顕性感染マウスは糞便中にウイルスを排出する。ウイルスは皮膚の微細な傷口から接触感染する。また、気道感染も成立する。1999年にアメリカで、本ウイルスに汚染した腫瘍細胞を動物に接種したため汚染が起こった事例が報告されている。
診断法は抗体検査が一般的であり、抗原は施設汚染の危険性を考慮し、抗原性が交差するワクシニアウイルスを用いる。
Mouse hepatitis virus (MHV: マウス肝炎ウイルス)
MHVはコロナウイルス科に属するRNAウイルスである。MHVには多数の株が存在し、大きく2つのタイプ、肝炎・脳炎等を起こす多臓器親和性の株と、腸炎を主病変とする腸管親和性の株に大別される。腸管、肝臓などの感染臓器や、DBT細胞などの株化細胞で特徴的な合胞体巨細胞を形成する。
自然宿主はマウスのみである。ウイルスに対する感受性はマウスの系統や週齢によって異なり、BALB/cやC57BL/6は高感受性、C3Hは抵抗性である。幼若マウスは感受性が高い。
MHVには多数の株が存在し、株により病原性が異なるが、現在流行している株の多くは弱毒株であり、ほとんどの事例でマウスに異常は認められず、抗体検査の陽性結果で初めて汚染に気付くことが多い。免疫不全マウスでは弱毒株であっても、持続感染を起こし、wasting syndrome(衰弱、削痩など)を呈する。
感染経路としては、感染マウスとの直接接触あるいは汚染した糞便や床敷を介して、経口あるいは経鼻感染する。また、腫瘍の移植などマウスへの接種材料にMHVが汚染していたために感染が起こる事例もある。
診断法には、ウイルス分離、PCRおよび抗体検査がある。免疫能正常なマウスでは多くが不顕性感染であることから、診断には血清抗体検査が一般的である。
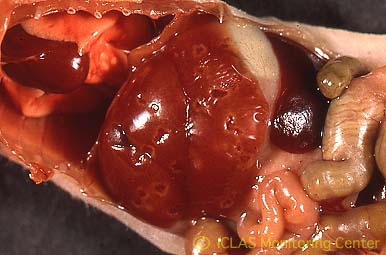
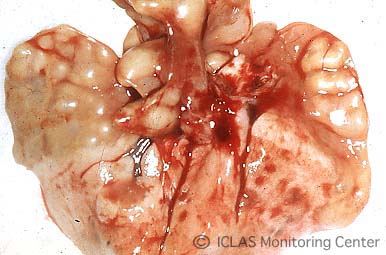
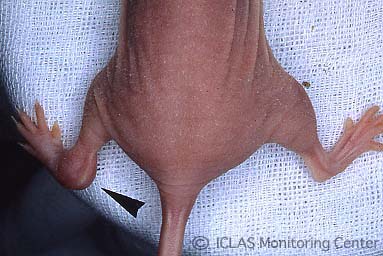
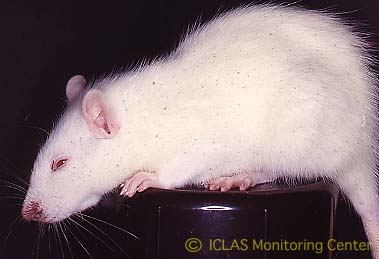
左: MHV自然感染ヌードマウスの外観所見 (写真右側マウスが感染マウス) : wasting syndrome(衰弱、削痩など)
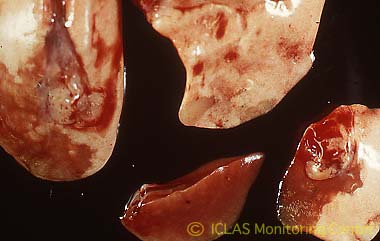
右: MHV感染マウスの剖検所見: 肝臓表面陥凹 (肝細胞壊死斑が融合) 、脾腫、腸管肥厚
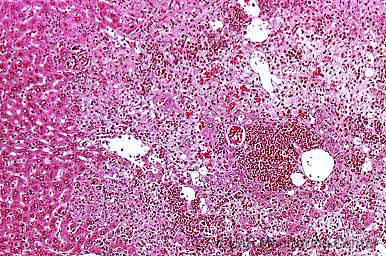
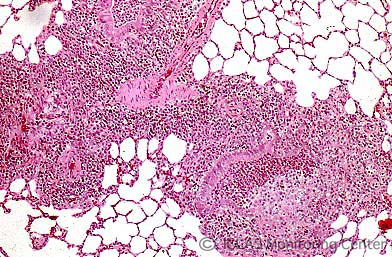
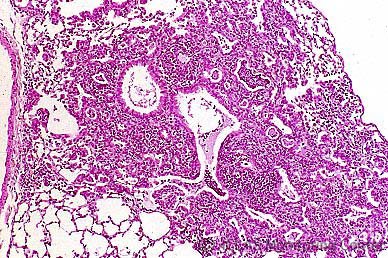
MHV感染マウスの肝組織 (H&E染色像) : MHV肝炎 (巣状壊死性肝炎)
Mycoplasma pulmonis (肺マイコプラズマ)
マウス・ラットに感染するマイコプラズマ属の菌種としては、Mycoplasma pulmonis 、
Mycoplasma arthritidis 、Mycoplasma neurolyticum などが報告されている。中でも、Mycoplasma pulmonis (肺マイコプラズマ: 以下Mp) は、コンベンショナルな飼育環境における汚染率は高く、重篤な慢性肺炎を起こす菌種であり、マウス・ラットの微生物コントロールにおいて重要な病原体のひとつである。
Mpは、他のマイコプラズマ属菌種と同様に、細胞壁を欠き、直径0.1~2μmと細菌に比べ微小で、特徴ある目玉焼き状のコロニーが実体顕微鏡下で観察できる。
Mpの自然宿主はマウス・ラットであり、一般的には、マウスよりもラットの方が重篤な肺炎を起こす。
Mpは空気感染 (飛沫感染) にて伝播し、感染後、慢性気管支性肺炎起こすため感染動物は生涯Mpを排出し続けるが、死亡率は低い。また膣、子宮内からも分離されることがあり、子宮切断法等を用いた感染動物クリーニング時には注意が必要である。
診断法は、菌分離および抗体検査を用いて実施されているが、菌分離 (鼻腔粘膜、気管粘膜のフキトリ材料をChanockのPPLO培地に接種後、微好気性条件で37℃、7日間培養し、発育したコロニー形成を実体顕微鏡にて観察) の方が抗体検査より検出感度が高い。
左: M. pulmonis 自然感染ラットの肺病変: 肺全葉に灰白色の結節性病変
右: M. pulmonis 汚染腫瘍細胞移植ヌードマウスに認められた関節炎
M. pulmonis 自然感染ラットの肺組織 (H&E染色像) : 気管支性肺炎
Pneumocystis spp. (ニューモシスティス) ; 免疫不全動物が対象
ニューモシスティス属は以前、原虫と考えられていたが、現在、真菌に分類されている。培地上に生えず、培養できない。
自然感染はマウス、ラット、ウサギ、ヒトなど様々な動物種で、それぞれ宿主固有のニューモシスティスが見出されており、マウスではP. murina 、ラットではP. carinii とP. wakefieldiae 、ウサギではP. oryctolagi 、ヒトではP. jirovecii が存在すると考えられている。ニューモシスティスはエアロゾル感染によって伝播され、免疫能が正常な動物では不顕性感染の経過をたどるとされているが、免疫不全動物では致死的な肺病変 (ニューモシスティス肺炎) を形成する。
診断法は、肺乳剤のToluidine blue O染色によるニューモシスティス嚢子の鏡検ならびにPCR法検査である。
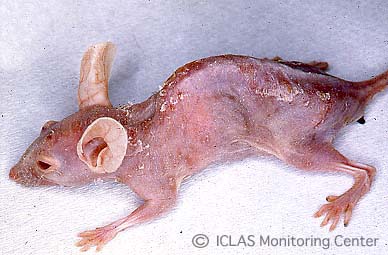
左: Pneumocystis 実験感染ヌードマウスの外観所見: 衰弱、削痩、チアノーゼ、背弯姿勢
右: Pneumocystis 実験感染ヌードマウスの肺病変: 肺退縮異常、肺赤色変化
Pneumocystis 実験感染ヌードマウスの肺組織 (Grocott染色像) : H&E染色所見で肺胞腔内に認められる泡沫状物質内に好銀性 (黒色) のPneumocystis 嚢子 (矢印)
Sendai virus (センダイウイルス)
センダイウイルスはパラミクソウイルス科に属するRNAウイルスである。別名をHVJ (Hemagglutinating Virus of Japan: HVJ) と呼ばれる。ヒト、モルモット、ニワトリ赤血球を凝集する赤血球凝集能を有する。
本ウイルスの宿主域は広く、マウス、ラット、モルモット、ウサギ、フェレット、マーモセットなどの感受性が知られており、経鼻感染する。感受性の最も高いマウス (DBA/2や129/Jなど) では、感染後2~3日で摂餌・摂水量の減少、立毛、呼吸困難等の症状を示す。感染後1週間~10日以内に死亡するか、耐過した場合には治癒する。若齢動物、特に乳仔は高い死亡率を示す。肺病変は感染初期に充出血、極期に赤色肝変化、修復期に灰色肝変化や瘢痕収縮による線状病変を示す。ヌードマウスでは例外的に持続感染し、慢性経過をたどってwasting syndrome(衰弱、削痩など)を呈し、死亡する。繁殖コロニーの汚染事例では生産効率の低下が観察される。ラットではマウスと同様の症状を示すが、感受性が低いため無症状のものも多い。
血清抗体は感染1週後には検出され始め、生涯にわたって強い免疫能が付与される。
診断は酵素抗体法 (ELISA法) および間接蛍光抗体法 (IFA法) による抗体検査一般的である。
ELISA法による抗体検査においては、パラインフルエンザウイルスとの交差反応が起きることがある。パラインフルエンザウイルス3型感染モルモット・ラットの例が過去報告されている。この場合、赤血球凝集抑制反応 (HI法) あるいはIFA法を用いた抗体検査を実施することで確認できる。
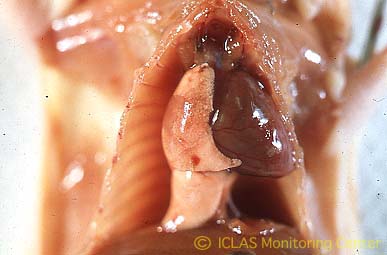
左: Sendai virus感染SDラットの外観所見: 削痩、背弯姿勢、立毛、紅涙、赤色鼻汁
右: Sendai virus実験感染ラットの肺病変 (感染中期) : 境界明瞭な赤色充実性肝変化
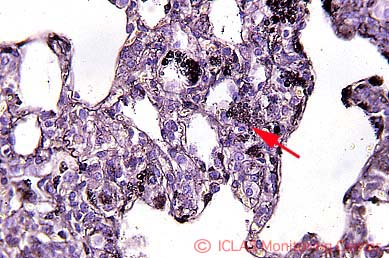
Sendai virus実験感染マウスの肺組織 (H&E染色像) : 気管支性肺炎


- A. 人獣共通感染症
- B. 伝染力が強く動物を致死させる恐れがある微生物
- C. 致死させることはないが発病あるいは不顕性感染を起こす微生物
- D. 日和見病原体
- E. 通常は病原性はないが、飼育環境の指標になる微生物